基因编辑技术的深度解析
基因编辑技术,又称基因组编辑或基因组工程,是一种新兴且精确的基因工程技术,它能够对生物体基因组的特定目标基因进行修饰。以下是对基因编辑技术的详细解析:
一、定义与原理
基因编辑技术通过利用经过基因工程改造的核酸酶(也被称为“分子剪刀”),在基因组中特定位置产生位点特异性双链断裂(DSB)。随后,生物体会通过非同源末端连接(NHEJ)或同源重组(HR)等机制来修复这些断裂。由于修复过程可能出错,从而导致靶向突变,即实现了对基因的编辑。
二、主要技术与工具
CRISPR/Cas9系统:这是目前应用最广泛的基因编辑工具。CRISPR-Cas系统源自原核生物的免疫系统,能够识别并切割外源DNA。通过设计特定的向导RNA(gRNA),CRISPR/Cas9系统可以精确定位到基因组中的目标序列并进行切割,实现高效且精准的基因编辑。
其他核酸酶:包括巨型核酸酶(Meganuclease)、锌指核酸酶(ZFNs)和转录激活样效应因子核酸酶(TALEN)等。这些核酸酶各有特点,如巨型核酸酶识别位点大,ZFN和TALEN则通过设计特定的DNA结合结构域来实现对目标基因的靶向切割。
三、应用领域
基础理论研究:基因编辑技术有助于揭示基因的功能和机制,推动生命科学的发展。
农业生产:通过基因编辑技术可以改良作物性状,如提高作物抗逆性、产量和品质等。此外,还可以用于防治植物病害。
医学研究:在基因治疗和遗传病治疗方面,基因编辑技术具有巨大潜力。例如,通过编辑生殖系细胞DNA,可以对后代的遗传性疾病进行预防和治疗。
一、基因敲除Knock out
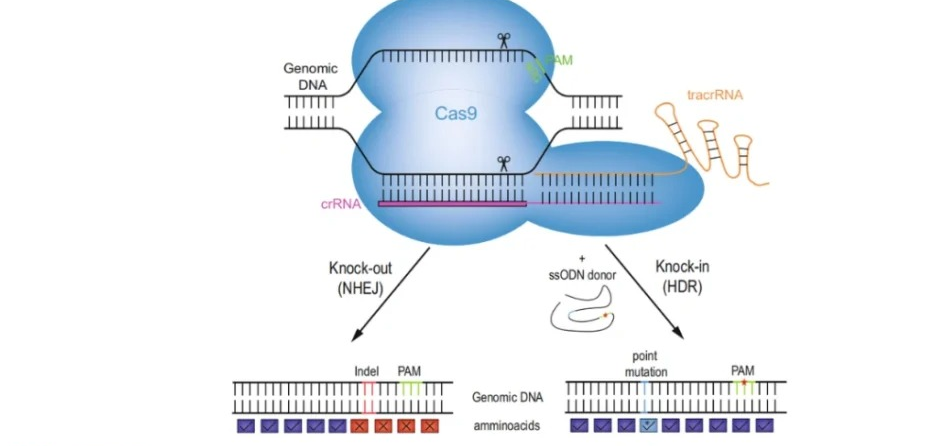
(1)原理:是用含有一定已知序列的小DNA片段与受体细胞gene组中序列相同或相近的gene发生同源重组,整合至受体细胞gene组中并得到表达的一种外源DNA导入技术。
(2)载体:①CRISPR/Cas9载体:通过Cas9核酸酶和sgRNA靶xiang序列精que定位并靶向基因DNA序列,然后引入双链断裂点,完成gene敲除。
②TALENs载体:包含特异性核酸酶和nuclease binding domain,通过切割靶向基因DNA序列,完成敲除和编辑。
③ZFNs载体:包含具有特异性的锌指结构域和核酸酶,通过切割靶向基因DNA序列,完成敲除和编辑。
(3)载体构建方法
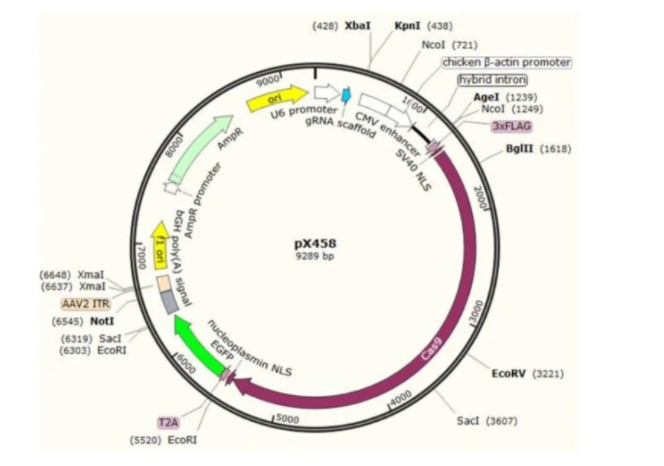
①设计和选择:设计gene敲除的靶点,选择CRISPR/Cas9等工具进行编辑
②载体插入:将编辑过的靶点序列插入到特定的载体中。
③转化和验证:转化编辑好的敲除载体至大肠杆菌中,进行筛选鉴定,验证敲除效果。
④导入目标细胞:通过病毒载体、电穿孔等方法将敲除载体导入到目标细胞中。
二、基因敲低
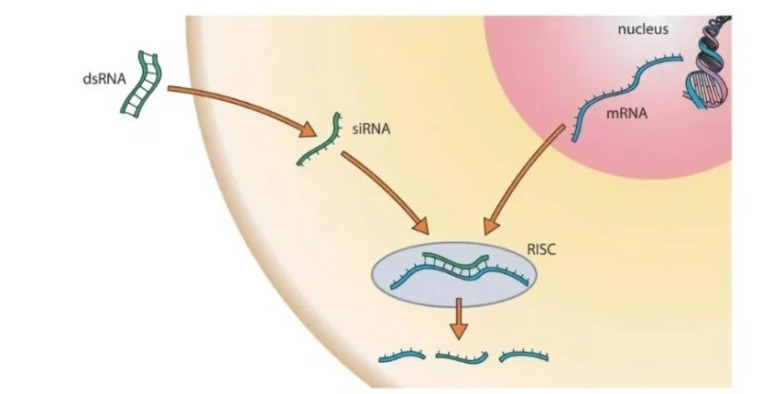
(1)原理:gene敲低又称gene敲降,是利用抑制剂来抑制gene的表达过程。有几种不同的抑制方式可用于抑制gene的表达,其中主要的抑制方式有RNA干扰技术(RNAi),CRISPR-Gas9技术以及gene转染技术。这些技术使用不同的原理,但它们的共同点是都能够发挥gene敲低的效果。
(2)载体:①siRNA载体:短干扰RNA。在3'端有两个碱基的游离,可激活RNA干扰,通过与目标mRNA互补结合序列,特异性地实现靶向mRNA降解。
②shRNA载体:短发夹RNA。一种siRNA前体,包括一个“茎”和一个“环”结构,由RNA序列的短区域(这些区域形成“茎”)之间的碱基配对形成,由不形成碱基对的短序列(形成“环”)隔开。
③CRISPRi载体:包含CRISPRi靶向序列和转录抑制子,通过抑制靶向gene的转录水平实现gene敲低效果。
(3)载体构建方法
①设计干扰序列:采用在线设计工具或经验公式来计算。
②合成和克隆:合成干扰序列的DNA或RNA小片段,并克隆到转录载体中,生成siRNA或shRNA表达载体。
③转化和筛选:将siRNA或shRNA表达载体转化至大肠杆菌中,进行筛选鉴定。
④导入目标细胞:通过病毒等途径将重组质粒导入目标细胞中。
三、基因敲入
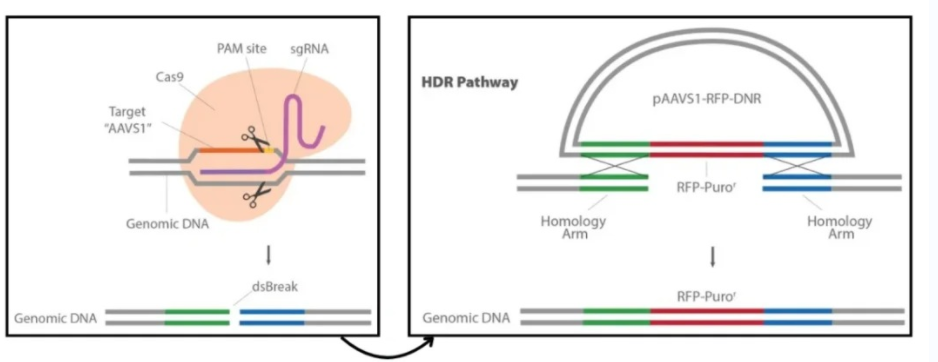
(1)原理:利用gene同源重组,将外源的功能gene(gene组原先不存在、或已失活的gene)转入细胞与gene组中的同源序列进行同源重组,插入到gene组中,在细胞内获得表达的技术。
(2)载体:①sgRNA-Cas9载体:在KI基因编辑系统中像一把“剪刀”,可以精准切开双链DNA,这把“剪刀”锋利与否和精确度能直接影响Kl基因编辑系统的编辑效率。②Donor DNA:一段高度同源的DNA模板。以Donor DNA为模板进行修复,可以将目的片段定点引入gene组。
(3)载体构建方法
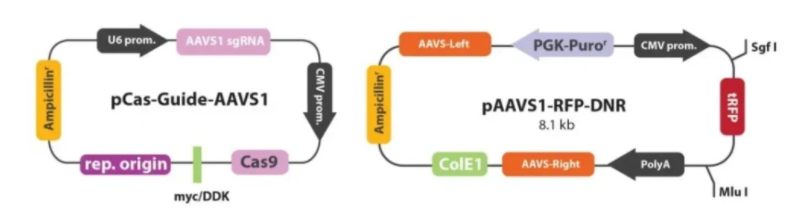
①设计sgRNA及修复DNA模版:为了保证sgRNA没有预ce的脱靶结合位点,根据人类AAVS1 AAVS1 Safe Harbor基因设计sgRNA,并进行软件分析。设计DNA修复模版,其两侧各有600bp的同源臂。
②构建sgRNA质粒及修复DNA模板质粒:选定sgRNA设计与CMV启动子驱动的Cas9基因,将其克隆到pCas-Guide中来制备pCas-Guide-AAVS1;再将DNA修复模板插入含有RFP-嘌呤霉素的pAAVS1-RFP-DNR表达载体。
③将sgRNA-Cas9、修复DNA模版共转293T细胞:用lipofectmine2000转染试剂将上述两种质粒转染至293T细胞。
免责声明:本号对所有原创、转载文章陈述与观点均保持中立,内容仅供读者学习和交流。文章、图片等版权归原作者享有,如有侵权,请留言联系更正或删除。

版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌侵权/违法违规的内容, 请发送邮件至 举报,一经查实,本站将立刻删除。
如需转载请保留出处:https://bianchenghao.cn/bian-cheng-ji-chu/109190.html