行研报告 | 类器官
目录
1、 类器官简介及市场规模
2、 类器官行业发展历程
3、 类器官主要成分及构建
4、 类器官的应用
4.1 建立疾病模型
4.2 药物研究
4.3 精准医疗
4.4 组织和器官再生
5、 类器官和其他模型的比较
6、 类器官临床应用的困境
7、 类器官药筛的标准化
7.1 取样标准化
7.2 全程自动化
8、 类器官的产业链发展
9、 类器官行业竞争格局
10、 部分项目介绍
1、类器官简介及市场规模
类器官(Organoids)是指利用成体干细胞或多能干细胞进行体外三维(3D)培养而形成的具有一定空间结构的组织类似物。其与对应的人类器官拥有高度相似的组织学特征,并能重现该器官的生理功能(因此也被称为“微型器官”)。
根据细胞来源的不同,类器官分为成体干细胞 (Adult stem cell,ASC)、多能干细胞(Pluripotent stem cell ,PSC) 或 肿 瘤 类 器 官 (Patient-derived organoid,PDO),而 PSC 又分为胚胎干细胞 (Embryonic stem cell,ESC) 和诱导多能干细胞 (induced Pluripotent stem cell, iPSC) 。
类器官拥有与来源组织一致的可自我更新的干细胞群,并且可通过使用含有特定细胞因子的培养基诱导这些干细胞扩增,从而实现类器官的稳定传代和持续培养。类器官包括多种细胞类型,更好地模拟了人体内细胞间、细胞与基质间的相互作用,从形态结构和表观遗传学方面都能很好地体现来源组织的特点,从而能更加仿真地了解人体内各种器官的生理病理机制,因此类器官在基础研究和临床诊疗研究中拥有广阔的应用前景。
将类器官技术应用于临床,指导临床用药和个体化治疗方向也是近期类器官技术的发展方向之一,事实上,自2016年起,类器官技术已被纳入临床试验中,截止到2020年9月,已有63起临床试验于FDA官方备案,其中更有8起临床试验的地点位于中国,这些临床试验的适应症包括肺癌、胰腺癌、结肠癌、乳腺癌、肝癌、食管癌等等。
相关报道称,2019年北美类器官市场达到2.9139亿美元,预计将在2027年达到14.0647亿美元,将以21.7%的复合年增长率增长。
根据世界卫生组织发布的最新数据,全球每年新发肿瘤1929万,而中国新发癌症457万,占比全球23.7%。预估国内类器官市场达百亿以上。随着新的药物管线的不断涌现,临床和患者对个体化治疗的需求日益增进,市场空间将持续增长。
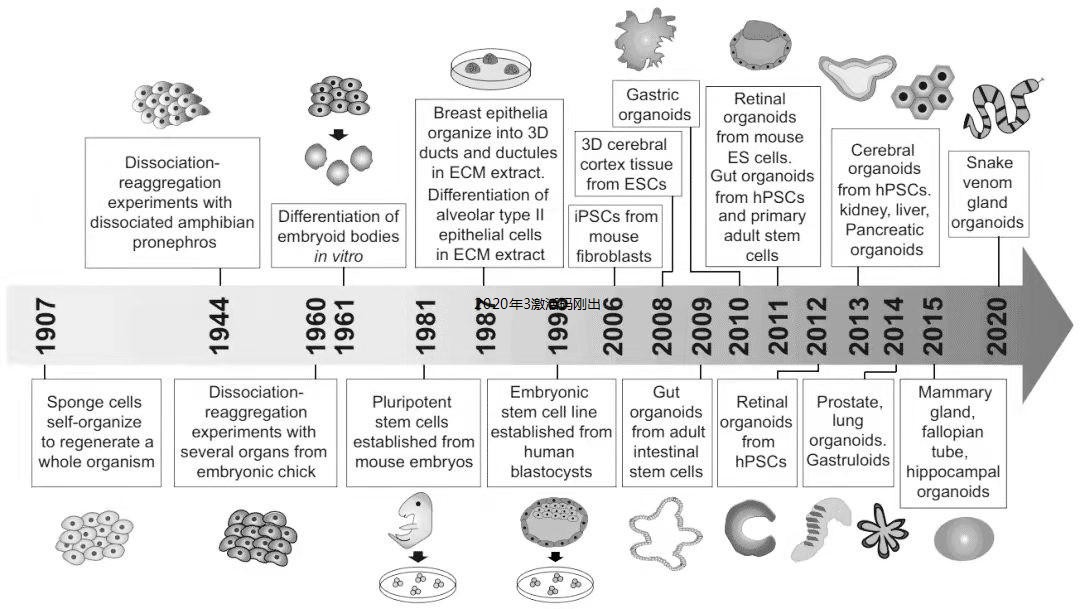
2、类器官行业发展历程
早在 20 世纪 80 年代,就经提出了“organoid”一词,但直到 2009 年,HANS CLEVERS 团队将成体干细胞培养出小肠的隐窝和绒毛结构,使得类器官的研究翻开了快速发展的新篇章 。2011 年,日本 RIKEN 发育生物学中心成功将胚胎干细胞培养成视杯结构。随后,各国团队分别构建出肝芽、迷你肾和微型大脑结构。2013年,《科学》(Science)杂志曾将类器官技术列入“十大突破”技术之一。直至2014年,纪念斯隆凯特林癌症中心首次证实在实验室培养出人源的前列腺肿瘤类器官 。之后,随着类器官研究的不断深入,多种脏器类器官被成功构建,其中包括小肠、胃、结肠、肺、膀胱、大脑、肝脏、胰腺、肾脏、卵巢、食道、心脏等,不仅包括正常器官组织类器官,还有相应肿瘤组织类器官,并在此基础上开展分子功能实验、药物筛选实验等,类器官在科研领域也发挥着越来越重要的作用。2018年2月23日,《科学》杂志上发表了震惊世界的研究结果,在预测抗癌药物的有效性和指导临床用药方面,与患者实际疗效进行对比,类器官有非常出色的预测性:100%的敏感性、93%的特异性、88%的阳性预测值以及100%的阴性预测值。
(a)小肠类器官形貌图.(b) 结肠类器官形貌图.(c)食管类器官形貌图.(d)胃类器官形貌图.(e) 肝脏类器官形貌图.(f)胰腺类器官形貌图.(g)肺类器官形貌图.(h)乳腺类器官形貌图.(i)肾类器官形貌图.(j)脑类器官形貌图.





3、类器官主要成分及构建
类器官培养系统主要包括基质胶、维持类器官生态所需因子和分化所需因子这几个主要元素。基质胶中含有胶原、巢蛋白和纤连蛋白等等,为类器官形成三维空间结构提供基质。维持类器官生态因子主要目的为促进细胞的增殖和抑制细胞凋亡等。
PDO的样本来源通常为肿瘤组织或者胸腹水等恶性积液,主流的培养方法包括较为常用的正置胶滴法、适用于肿瘤和睾丸类器官培养的倒置胶滴法、适用于有气体接触的黏膜类器官(肠、呼吸道)培养的气液界面法以及需要较大扩增(脑类器官)的生物反应器法等。
正置胶滴法是较为常用的类器官培养方法,其具体操作为:肿瘤细胞系生长至贴壁细胞铺满瓶壁80%时,加2ml消化液进行消化,获得单细胞悬液,台盼兰排斥染色法计数。在冰浴的条件下,将I型胶原蛋白溶液、10×F12培养基和缓冲溶液按体积比8:1:1混合制成胶原蛋白混合溶液。将准备的肿瘤细胞悬液加入胶原蛋白混合溶液,调整到细胞浓度为1×105个/ml。在冰浴的条件下,将胶原蛋白-细胞混合溶液接种于6孔细胞培养板,每孔均接种3滴(30u1/滴),接种量为3000个细胞/滴,将培养板置于5% CO2、37℃细胞培养箱内1小时以形成胶滴,再加入含10%FBS的IMDM培养基,进行培养。
倒置胶滴法又叫悬滴法,是近年来细胞三维培养的一种,其操作简便,可以在悬浮状态下自发成球,适合于肿瘤、睾丸等类器官培养法。悬滴细胞培养方法是通过将单细胞悬液形成一个个独立的悬滴,细胞在悬滴内聚集成细胞球。目前,悬滴的形成多采用手工法,即先将细胞悬液滴在平板(如细胞培养皿的盖,由塑料或玻璃材料制成)上,然后小心反转,使液滴面向下,液滴借重力下垂。这种方法存在一定的弊端,其一是滴加了液滴的平板在反转时液滴容易滑动,发生液滴彼此融合;其二是液滴在平板上的分布和排列难以规范,不利于实验的重复性和规模化分组研究。为弥补上述不足,近年来出现了基于传统96孔细胞培养板的悬滴细胞培养板,该产品是将96孔板的底部开孔,让加到孔内的细胞悬液通过底部的孔自然漏出形成悬滴。
气-液界面培养被认为是呼吸系统生理学高度相关的培养体系,能够克服2D培养的许多挑战。目前的2D细胞培养存在一些缺点,如组织特异性结构丢失、细胞分化缺失和屏障完整性受损,所有这些特征在研究呼吸系统疾病时都非常重要。气-液界面培养法中细胞接种小室后,首先淹没在培养基中培养到完全融合,再进行“air-lifted”处理,即让下部与基部表面的液体接触,顶端暴露在空气中,可以促使气道上皮细胞呈假复层形态、粘液纤毛分化和粘液分泌,并具有屏障功能等,从而很好地模拟肺上皮细胞的体内特性。有着30多年细胞培养分析经验的德国品牌PromoCell提供气-液界面培养系统——标准化的不含血清和牛垂体提取物气液界面培养基与ALI预筛选的人支气管上皮细胞相结合,能很好地模拟气道上皮,并显示出与人体气道相似的形态和功能特征,帮助研究者建立一个具有稳定、可预测上皮屏障功能的可重复3D气道模型。
生物反应器法是以生物反应器为核心,通过悬浮或者支架贴壁的方式在生物反应器内构建3D培养环境,采用工程技术手段对生物反应器内的环境参数如温度、pH值及溶解氧浓度等实时在线测控,并辅以循环灌注的手段,加强营养传输和物质交换,从而构建适合细胞生长增殖的培养条件。动物细胞体外培养时,生物反应器是整个培养过程的关键设备,为细胞提供了一个适宜的生长环境,使之快速增殖并形成所需的生物组织制品。
以肠道肿瘤类器官的培养流程为例,首先将患者来源的肿瘤样本组织通过机械剪切得到肿瘤细胞团,再将细胞团酶消化成单细胞。分离消化后,将细胞嵌入到基质胶中并在96/384孔板上进行胶滴的种接,再覆盖以培养基和细胞因子培养。类器官培养至直径几百微米的细胞小球即可用于药筛。类器官培养特有的重要试剂包括消化液、培养基(例如Wnt、R-Spondin、Noggin等细胞因子)、基质胶(Matrigel等),这些试剂在不同实验室、公司以及培养不同种类的类器官之间的差异性较大。
类器官作为新型的药筛模型,成本虽然较PDX更低,但还是远高于细胞系。类器官成本占比较高的包括培养使用的基质胶。
常用的基质胶为美国BD Biosciences公司的Matrigel®,在行业内处于较为垄断的地位,价格较高。Matrigel可以产生类似于哺乳动物细胞基底膜的生物活性基质材料,帮助多种类型的细胞达到附着和分化。Matrigel的来源是小鼠肉瘤细胞系,除了成本较高的问题,同时批次间存在一定的变异性。且由于是动物来源,对于有机类的药物的检测有局限性。考虑到小鼠来源的细胞外基质对于药物筛选实验结果存在一定的干扰,因此基质的工程技术开发用于合成外源差异较小的、非动物来源的基质胶用于成本下降和性能优化将是类器官产业化需要解决的关键性问题之一。
基质胶以外,培养也涉及多种细胞因子组合使用,细胞生长因子通常也价格不菲。选择效果更好的细胞因子以及尝试减少使用细胞因子的数量也可以带来成本下降的空间。
4、类器官的应用
4.1 建立疾病模型
类器官模型最显著的优势是人源性、近生理性,遗传病患者来源的类器官为研究复杂的多基因疾病、尚未阐明的风险基因位点和表型高度异质性的疾病机制提供可能。
4.2 药物研究
绝大多数候选药物在Ⅰ期试验进行到临床批准过程中被中止,其中器官毒性是主要原因,最常见的是肝脏和肾脏药物性损伤。目前常用的细胞和动物实验结果并不能顺利转化到临床,而人源性类器官为药物毒性预测提供更精确的手段。
此外,类器官还可用于药物筛选。在药物研究中,尤其是针对罕见病或缺乏大规模临床试验时,类器官能够为深度测序和功能测试、突变位点或表型分析提供足够资源,是药物毒性预测、新药筛选、个体化治疗的较好模型。
类器官应用于药筛的头部公司,需要具备泛癌种培养能力以及达到商业转化水平的稳定性的水平,有严格的质量控制和标准化体系,且在培养涉及的仪器和鉴定筛选平台方面需要往自动化方向靠拢,后文将对该方面做详细阐述。
4.3 精准医疗
对于癌症精准治疗而言,体外模型必须在生物学特性、基因突变谱上与体内肿瘤保持一致,而且能够维持高度异质性和基因型稳定性,如今肿瘤类器官的出现为癌症精准医疗创造了新的机遇。
当前肿瘤的异质性是导致抗肿瘤药物无效或耐药复发的主要原因之一。即使是基因突变谱相同的患者,其药物反应也各异。另外,一些罕见突变,也需要进行药物疗效个体化测试。因此,越来越多的研究建立了肿瘤类器官生物库进行抗肿瘤药物高通量筛选和预测药物反应。
国内外目前,共有超过40项类器官临床相关研究,研究单位和临床注册主体多为医院。在中国的注册临床中,类器官以化疗药的敏感性检测作为主流应用,类器官用于检测靶向药和免疫治疗的敏感性在未来还有极大的发挥空间和应用潜力。
4.4 组织和器官再生
再生医学的主要目标是在体外用健康组织替代某一功能或结构受损的器官,实现无免疫抑制、无并发症和毒性减少,避免因终生抗排斥治疗产生巨额的费用。虽然现代医学已经能够实现异体移植,尤其在治疗终末期器官衰竭如心脏、肝脏或肾脏中,器官移植仍是临床主要采用的方法,但是存在供体数量严重短缺以及组织排斥等问题,因此寻找新的组织来源十分迫切。类器官能够同基因组织扩增从而用于自体移植,为器官替代策略提供可再生资源。
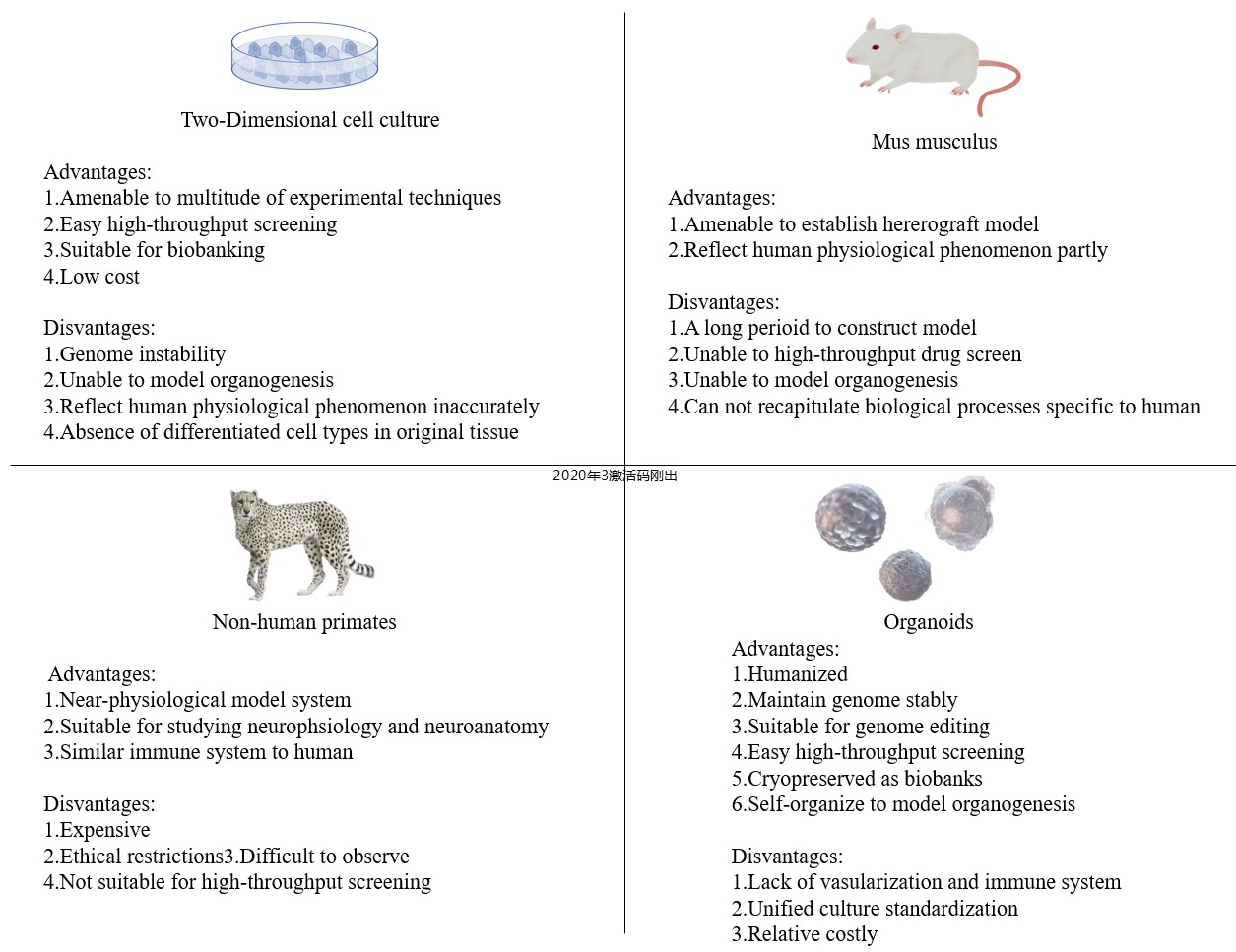
5、类器官和其他模型的比较
目前,最常见的模型是细胞系、酵母、秀丽隐杆线虫、黑腹果蝇、普通小鼠和斑马鱼,以及异种移植模型 (Patient-derived xenograft,PDX) 等,已被广泛用于研究细胞信号通路、识别潜在的药物靶点、开发新药等方面,但也暴露出许多局限性。
(1)2D (Two-dimensional) 细胞系虽操作简便,但通常只包含单一细胞类型,诸如肿瘤细胞系,缺乏原始肿瘤的异质性并且在体外培养中基因组不稳定。
(2)小鼠模型是大部分实验室最常用的研究模型,但它和人类特有的生物现象存在固有差异,如大脑发育、新陈代谢和药物疗效等。
(3)非人灵长类 (Non-human primate,NHP) 虽然在系统进化树上和人类最接近,具有高度相似的免疫系统、大脑结构和认知功能,但是价格昂贵,同时存在伦理限制、成像观察的局限性、不可控的复杂变量、难以进行药物高通量筛选等缺陷,限制其广泛应用。
因此,根据“3R”原则 (Reduce,Reuse,Recycle) 和物种保护原则,需要探索能够缩小与人体差异又兼具稳定、易操作、可广泛应用的模型替代系统,来研究遗传多样性、疾病发病机制和预测药物反应。
临床试验数据证实,直肠癌类器官(RCO)可以准确概括相应肿瘤的病理生理和遗传变化。患者的化学放射反应与RCO反应高度匹配,准确度为84.43%,敏感性为78.01%,特异性为91.97%。这些数据表明,PDO在临床上可预测LARC患者的反应,并可能成为直肠癌治疗中的辅助诊断工具。
与传统模型相比,类器官具有以下特性:
(1)自组装形成 3D 结构:在外源信号的调节作用下,多向分化并自我构建成类似其来源的组织或者器官,模拟体内器官发育过程;
(2)具备器官的部分特定功能,如肺的呼吸功能、肠道的营养吸收、肾脏的滤过功能等;
(3)来源广泛,可大量扩增并保持基因组的稳定性,可基因编辑操作和高通量筛选。
如图3所示,根据类器官模型的特点,与传统模型互补应用而非取代,将为人类生物学研究开辟新的途径。





6、类器官临床应用的困境
类器官现在面临的关键技术瓶颈是无法实现体积和功能的同步生长,而解决此问题首先需要解决其中的主要问题,包括培养方式、血管化及定量化研究等。
(1)血管化。目前大多类器官本身并不具备血管化的结构。因此,随着类器官体积的增长,类器官受限于氧气的缺失以及代谢废物的增加,可能导致的组织坏死。已有研究构建血管内皮细胞微环境的肿瘤类器官,将类器官肿瘤细胞和血管内皮细胞在Matrigel上共同培养,生成血管结构以期解决类器官血管化缺失的问题。
(2)免疫化。血管化以外的难点还包括模拟肿瘤和免疫环境的相互作用关系。2019年Nature Protocol发表了肿瘤类器官和免疫细胞共同培养的相关protocol,可以体现和模拟出肿瘤微环境的部分特征。以上皮类器官和免疫细胞共培养模型为例,可通过在培养基中添加活化的免疫细胞、在组织消化成单细胞后和免疫细胞共同生长、添加ECM中的重组细胞因子等方法重塑类器官和免疫细胞的相互作用。
(3)系统化。相比于单个类器官,类器官系统的构建能够对药物疗效和潜在毒性做出更完整全面的评估。目前类器官仅能检测出药物对于肿瘤的抑制效果,对于其他器官组织是否存在其他副作用和安全性风险并不能做出预判。为了解决这一问题,2017年Skardal et al.构建了有心脏、肺部、肝脏组成的集成于闭合循环体中的类器官系统,以达到全面揭示药物对不同器官的毒性和药效的目的。
从临床应用的角度分析,类器官很难完美模拟出原肿瘤的全部功能。肿瘤组织在人体中是高度异质性的复杂存在,但是对于预测药敏的关键指标来说(如细胞抑制率),类器官只需要达到一定程度的复杂性即可给出较好的答案。
7、类器官药筛的标准化
7.1 取样标准化
标准化的第一步即类器官取样。肿瘤组织取样的部分非常关键,初始的样本量及细胞质量直接决定了类器官培养的成功率。样本需要高活性和干性的细胞,对于肿瘤组织来说,最好是来源于干细胞。外层的细胞处于分化的终末期,干性较差;而位于内层的细胞常常处于缺氧坏死的状态,活性较差。
以胰腺癌为例,只有小于20%的患者能够通过根治性手术切除获得肿瘤切除样本。余下高达80%的患者发现即为中晚期,无法通过手术获得足量的组织样本,类器官样本常常通过超声内镜引导下的细针穿刺活检(EUS-FNA)。
EUS-FNA穿刺获得的样本量较手术中穿刺的更少,同时还与临床操作医生的经验相关。如果穿刺样本量很少、活细胞数量较少、或者没有穿刺到阳性的细胞群,类器官的构建都会面临着较大挑战。对于在肿瘤的什么病灶取什么样本、样本需要满足什么样的条件等需要建立严格的标准以保证后续类器官培养的成功。
7.2 全程自动化
类器官从取样到药筛的每一个步骤都需要严格把控,对于标准化有很高的要求,可以推测未来类器官培养环节也将提高自动化程度,尽可能提高类器官的可重复性。
类器官需要在凝胶状Matrigel中嵌入生长,物理参数和生长因子可及性的局部差异可能带来类器官在形状、大小和分布等方面的差异性,而临床上药筛类器官的应用需要达到较高的均一性。Lutolf et al.发表了关于类器官培养的自动化技术,采用了非固态的基质,构建了微型工程的水凝胶细胞培养装置。对比传统的Matrigel,非固体的基质使得类器官的均一性和可重复性得到提高,同时也为下游的分析提供了便利性。
另外,在类器官鉴定中,采取人工智能的判读对类器官活性、大小等主要参数进行评估,可以同时保证有效性和时效性,进一步缩短整个类器官药筛流程的周期。类器官只有在建立完善的技术标准体系后,类器官的相关研究才能被进一步推动,类器官产业化才得以发展。
8、类器官的产业链发展
产业链上游,以提供类器官培养的耗材(包括培养基、细胞生长因子、冻存液、消化液、基质胶等)和设备为主。其中包括老牌的STEMCELL Technologies等细胞试剂提供商和专注于提供类器官试剂的新兴公司(如Prellis Biologics的血管化3D Scaffold、X cell Biosciences的微环境模拟系统等)。
产业链中游,以提供人或者动物类器官的培养、类器官的冻存建库以及类器官的传代的服务为主。
产业链下游,致力于类器官应用的公司通过和药企合作进行新药研发,或者建立患者来源的类器官进行肿瘤药敏筛查,数量并不很多。国外比较有代表性的下游公司包括美国的System 1 Biosciences公司,在2018年末获得了Pfizer Ventures和CRV共同领投的2500万美元的A轮投资,主要开发神经细胞类的类器官用于药物开发。
9、类器官行业竞争格局
类器官行业在欧洲国家发展较为迅速,这和欧洲类器官科研最早起步以及积累最多息息相关。类器官的领头人Hans Clevers成立的Hubrecht Organoid Technology(HUB)是类器官最早的研发中心,HUB技术授权促进了Epistem、Cellesce、Crown Biosciences、STEMCELL Technologies在内的一批类器官公司的涌现。
中国在类器官领域中,近年来呈现出科研数量大幅度上升的趋势,尤其在2019-2020年这两年间显现出了强劲的发展势头,发表的文献数量在全球的排名从第六位(2009-2019年)跃至第二位(2020年),仅次于美国。
2021年2月23日,国家药品监督管理局食品药品审核查验中心官网重磅发布《基因修饰细胞治疗产品非临床研究与评价技术指导原则》(征求意见稿),其中对动物种属/模型选择方面提到,当缺少相关动物模型时,可采用基于细胞和组织的模型(如 2D 和3D 组织模型、类器官和微流体模型),这些模拟人体内环境的模型也可为有效性和安全性的评估提供有用的补充信息。随着类器官研究的不断深入和政策的不断完善,类器官将在转化医学和临床个体化治疗上扮演越来越重要的角色。
参考欧洲的类器官发展模式,可以预计中国基础科研积累的提升将加速类器官产业化的进程,在不远的将来我们也将看到更多类器官公司的涌现。
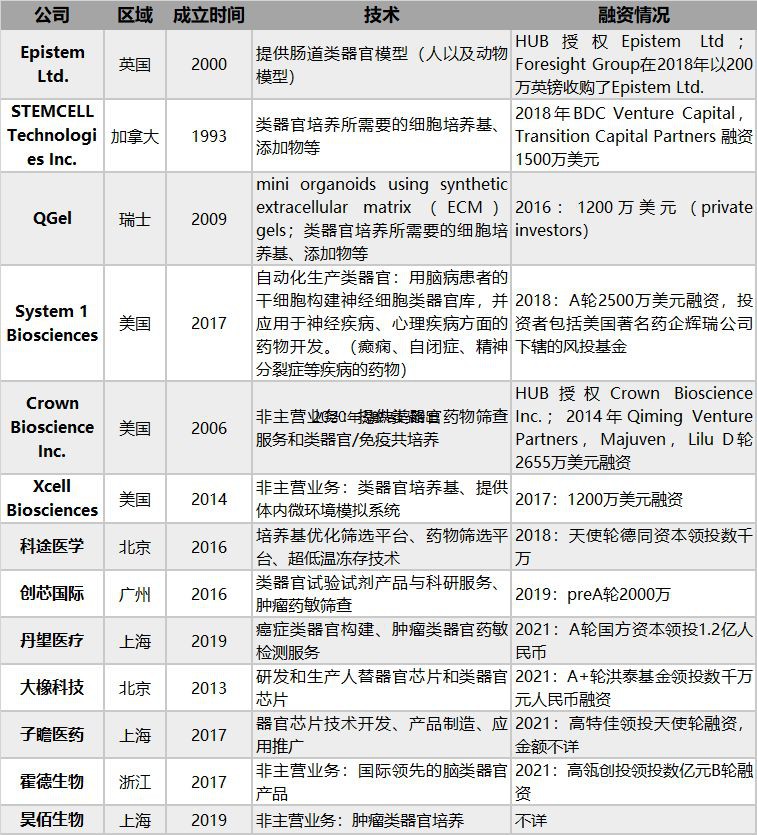





从投融资次数和金额来看,类器官整个行业都还处于比较早期的阶段,类器官行业尚未在国内形成集中化产业集群。竞争刚刚起步,拥有核心技术优势和完整生产链、尽早布局该行业的企业将具有先发优势。
10、部分项目介绍
10.1 Xilis(新锐)
类器官领域国外市场可对标公司Xilis(新锐),Xilis是一家美国类器官指导精准疗法开发商,成立于2019年,由杜克大学(Duke University)的Xiling Shen博士,David Hsu博士,与Hans Clevers博士创立,其中Hans Clevers博士是类器官技术先驱之一,2009年,Hans Clevers领导的团队用来源于小鼠肠道的成体肠干细胞培育出首个微型肠道类器官,曾获得有“科学界奥斯卡”之称的科学突破奖。
Xilis开发了专有的 MicroOrganoSphere(MOS)类器官技术平台,该平台使用来自癌症患者的组织样本重建其肿瘤的微小模型,它可以保留原始组织样本独特的组织结构、基因表达、免疫微环境和组织病理学,克服了包括异种移植和类器官在内多种肿瘤模型的主要局限。利用MOS和Xilis的AI成像分析工具,Xilis正在开发一种精准肿瘤学平台,可以快速准确预测治疗反应,帮助临床医生及时制定有针对性的个体化癌症治疗策略。 从患者活检取样到获得结果的整个过程只需要不到两周的时间,能够大大减少患者的无效治疗周期,有助于降低癌症治疗成本负担。此外,MOS还具有分析真实的肿瘤微环境、高通量临床前建模和临床患者筛选能力,可以加快癌症药物的开发和临床试验。
MOS技术是一项革命性的免疫疗法开发技术:(1)利用MOS和AI驱动的算法,Xilis正在开发其精准肿瘤学平台,以精准预测治疗反应,以帮助临床医生为患者确定治疗方案的优先级。从患者活检到结果的整个过程不超过两周,可以实现广泛的临床应用;(2)MOS技术可实现高保真药物发现和开发,药物开发人员可以在研发的多个阶段使用MOS平台,包括早期发现、临床前毒性和疗效、生物分析测试和临床试验。
2021年7月8日,生物科技初创公司Xilis宣布完成一项7000万美元的 A 轮融资。本轮融资将用于进一步推进Xilis专有的MicroOrganoSphere™(MOS)类器官技术平台,扩大其AI驱动的能力,为癌症患者提供个体化的精准治疗策略,并加速药物发现和开发。
10.2 Weitz实验室
David A. Weitz 教授是美国哈佛大学(Harvard University)物理系和工程与应用科学学院的冠名讲席教授,美国科学院院士、美国艺术与科学学院院士,学术成就斐然。Weitz 教授1978年在美国哈佛大学获得博士学位,1978-1995年期间在美国Exxon Research and Engineering Co. 任研究科学家,1995-1999年期间在美国宾夕法尼亚大学(University of Pennsylvania)任教授,1999年至今在美国哈佛大学物理系和工程与应用科学学院任教授,2001年至今兼任美国哈佛材料研究科学与工程中心主任,2006年至今兼任美国哈佛大学系统生物学系教授。迄今,Weitz教授已发表高水平学术期刊论文400多篇,其中在Science, Nature, Nature Materials等国际顶级刊物上发表30余篇,申请发明专利超过50项,应邀在世界各地做过500多次邀请学术报告。Weitz教授是国际上软湿功能材料、胶体微粒系统、生物物理与生物材料、微流控等研究领域的知名专家,学术造诣颇深,具有很高的学术地位和非常大的国际学术影响力。
液滴中的器官:2016年该实验室的一篇文章中使用基于液滴的微流控技术,将肝细胞和成纤维细胞分层组装成3D核-壳支架,在每个液滴中形成人造肝脏,并表明嵌入3D核-壳支架中的肝细胞和成纤维细胞的共培养是体外肝脏的良好模型,具有同型和异型细胞间相互作用的平衡,有利于其表达肝脏的特定功能。
10.3 Emulate
Emulate是一家位于美国波士顿地区的私人控股公司,致力于创造理解疾病,药品,化学品和食品如何影响人类健康的生物产品2023.2.3 IntelliJ IDEA安装激活教程(附激活工具及激活码 收藏)。Human Emulation System为重现真实人体生物环境设定了新的标准,正在用于推进产品创新,设计和安全,领域涵盖药物开发,农业,化妆品,食品和化学消费品等。Emulate的创始团队在哈佛大学Wyss生物创新工程研究所(Wyss Institute for Biologically Inspired Engineering)率先推出了Organs-on-Chips技术。该公司拥有哈佛大学在全球范围内的独家授权,可为该技术及相关系统提供强大而广泛的知识产权组合。
Emulate通过与行业合作伙伴的合作和内部研发项目,持续开发多种器官芯片和疾病模型。Emulate还正在与临床合作伙伴合作,使用患者的干细胞生产个体化的器官芯片,应用于精准医学和个体化医疗领域。基于Emulate的Organs-on-Chips技术,该公司创建了Human Emulation System,为人体内部的生物运作提供了高保真窗口。这项技术平台为研究人员提供了一种预测人类对疾病,药物,化学物质和食物产生反应的新标准,比细胞培养或动物测试方法具有更高的精确度和控制能力。
Human Emulation System系统由器官芯片,仪器和软件程序组成。该公司将为其器官芯片产品增加先进的生物学功能,包括肝脏芯片,肠芯片,肺芯片,脑芯片以及与人体相关的血栓形成和免疫系统调节模型。扩大的器官芯片产品套件还将包括一系列疾病模型,旨在进行药物功效测试并阐明疾病机制的新见解。此外,Human Emulation System将通过新的软件程序得到增强,进行数据分析,并与标准分析方法相结合,促进使用Emulate平台团队之间的协作。
Emulate的器官芯片(Organs-on-Chips)技术已被用于重建各种不同器官的功能,包括肝、肠、脑、肾和肺。该公司的器官芯片大小与AA电池相当,具有两个流体通道,可产生血液和其他液体的流动。这些芯片由柔性聚合物制成,可以拉伸以重现与呼吸或蠕动类似的运动。
Emulate公司开发的一种人体仿真系统,将其器官芯片与硬件和软件应用程序相结合。该系统旨在降低使用器官芯片技术的一些复杂性,并围绕器官芯片构建,该系统重建了体内发现的器官的微环境。一种名为Zoe Culture Module的仪器提供压力驱动的流动,并像人体一样重现灌注压力和剪切力。
10.4 OcellO
OcellO是一家行业领先的使用先进的癌症,炎症和多囊生的器官型人体组织提供化合物测试公司。自动3D细胞培养与高含量三维成像和分析提供了一个坚实的可延展而不损害生物复杂性的样本分析平台。 肿瘤药物开发服务包括类器官,人源化类器官和人源化肿瘤异体移植模型代表大多数实体瘤的模型并结合了不同的免疫系统。
今天的文章2020年3激活码刚出分享到此就结束了,感谢您的阅读。
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌侵权/违法违规的内容, 请发送邮件至 举报,一经查实,本站将立刻删除。
如需转载请保留出处:https://bianchenghao.cn/73061.html

