DOI:10.1021/acssynbio.8b00241
杂志:ACS Synthetic Biology
Online: Sep 2018
通讯作者:Douglas S. Clark,美国加州大学
文章链接:
https://doi.org/10.1021/acssynbio.8b00241
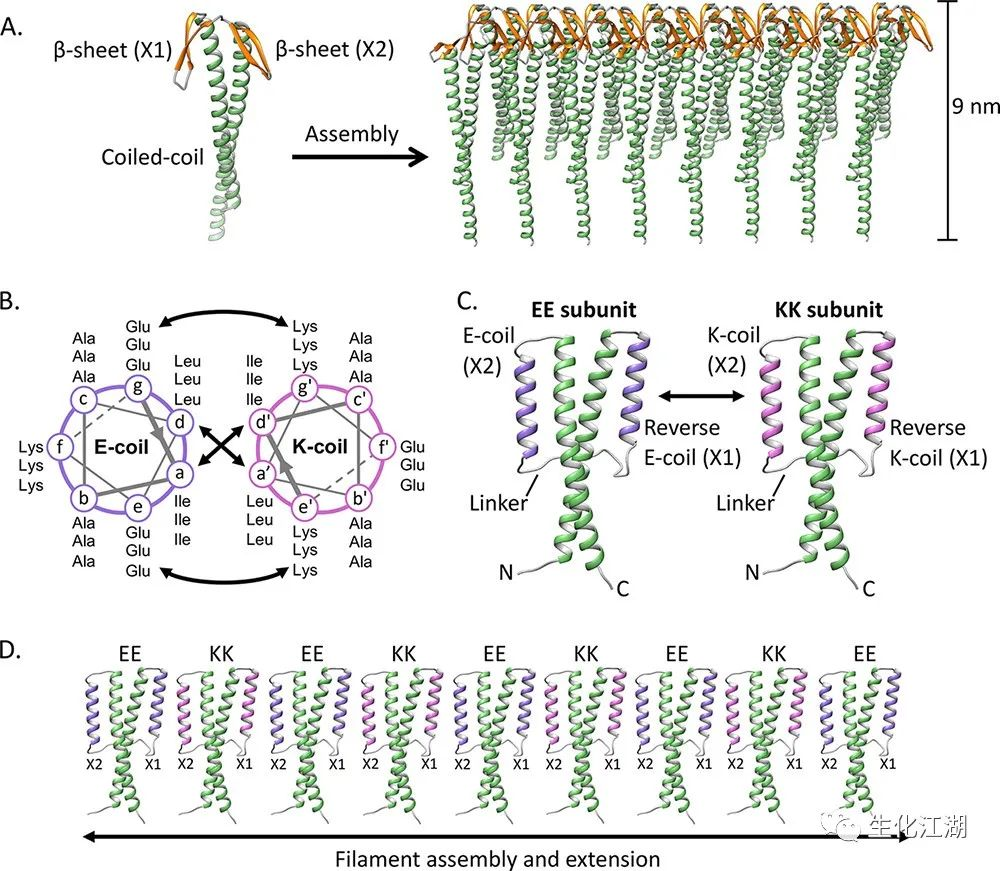
蛋白质模板的构建依赖于对单个蛋白质亚基之间的接口进行工程化,以驱动自组装成特定的功能结构。有一种方法取得了显著的成功,它使用简单的卷曲螺旋结构元素来创建复杂的组件。卷曲螺旋结构域是缠绕在一起的螺旋序列,它们通过疏水和静电相互作用在7个传统标记的abcdefg残基重复序列中结合在一起,疏水残基通常位于a和d位置。这些蛋白质结构域是工程纳米结构具有吸引力的界面,因为控制卷曲螺旋组装的规则已经被很好地理解,这有助于重新设计卷曲螺旋的合理设计。这些工程化的卷曲螺旋已被用于构建新型结构和支架。
研究摘要
开拓蛋白质自组装成结构模板的能力,可以为功能分子在纳米技术中的定位提供新的途径。本文报告了由不同的单体组成的多组分蛋白质模板的工程,这些单体以重复的顺序组装成一个动态的功能结构。这是通过用螺旋序列重新设计分子伴侣的蛋白质-蛋白质界面来创造独特的亚单位,这些亚单位通过正交的卷曲螺旋组装成长达几百纳米的长丝。随后,研究表明,功能蛋白可以融合到亚基上,以实现沿着丝的有序排列。重要的是,多组分丝状物具有分子伴侣活性,可以阻止其他蛋白质的热诱导聚集,这是一种潜在的酶支架材料。这项工作中的设计被提出作为一个概念的证明,模块模板可能被用来定位功能分子,稳定其他蛋白质,如酶,并使具有独特拓扑结构的纳米结构的可控组装成为可能。
研究内容
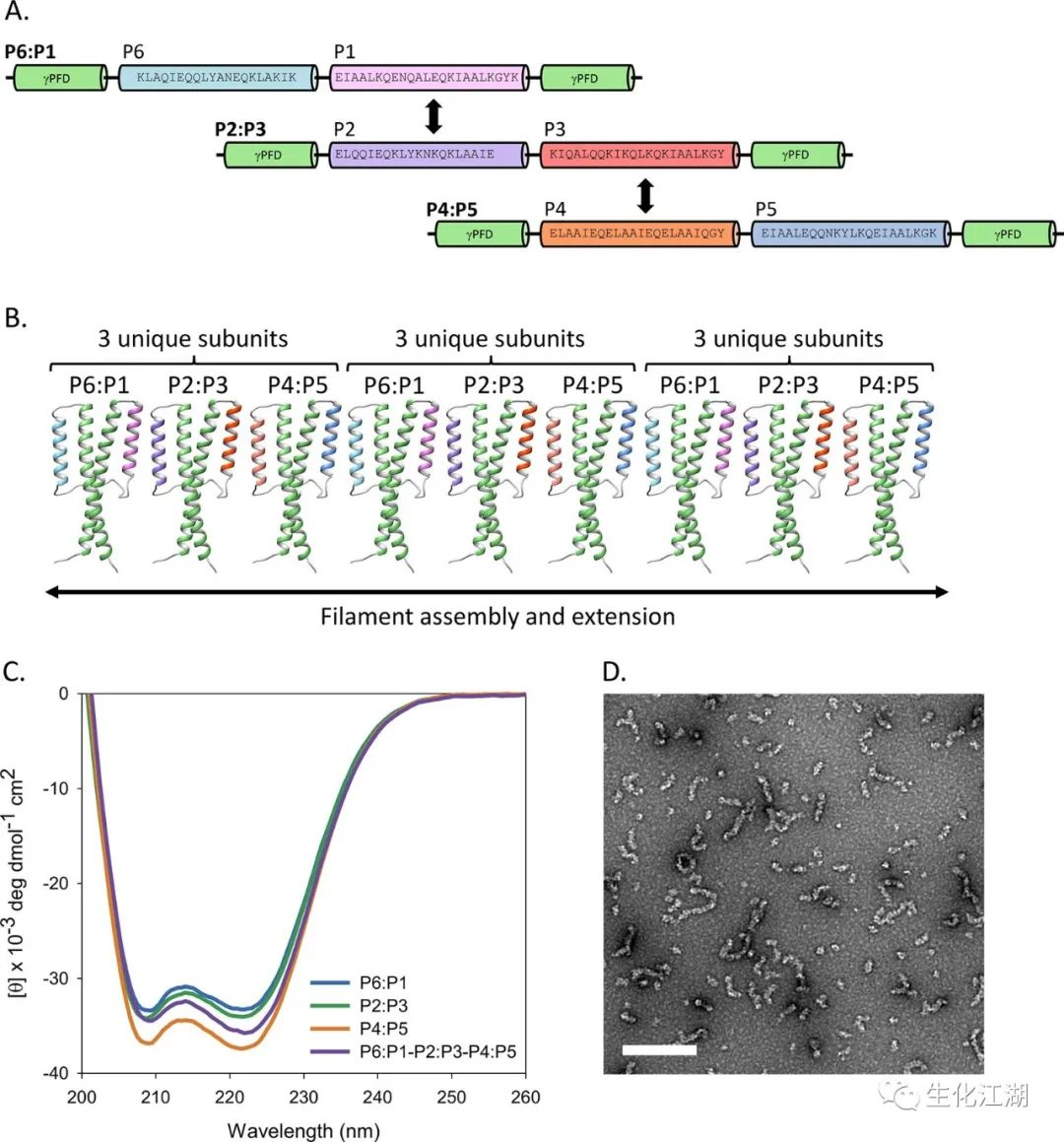
用螺旋序列替换γ-PFD的X1和X2 β-折叠(图1A)。选择异二聚体E3/K3卷曲螺旋的螺旋线代替β-折叠形成特异的结合伙伴。E3/K3卷曲螺旋由两个相反带电的螺旋结构域组成,分别富含谷氨酸和赖氨酸残基(图1B)。E-和K-coil固有地形成平行的卷曲螺旋;反向E-coil或K-coil的序列都可以产生二聚反平行的卷曲螺旋。引入了一个反向的E-coil或一个反向的K-coil来代替X1 β-折叠,并且在X2位置引入了原始的E-coil或K-coil,从而创建了亚单位分别是“EE”和“KK”。两个引入的螺旋序列通过一个柔性的甘氨酸-丝氨酸连接体连接。E-或K-coil代替β-折叠,在X1位置有一个工程螺旋向下延伸,在向上延伸的X2位置通过柔性连接体连接(图1C)。亚基通过在亚基中引入的螺旋之间形成反平行的卷曲线圈而低聚成杂聚肽丝(图1D)。这种组装也会导致γ-PFD的自然卷曲螺旋向外突出,以进行潜在的伴侣活动。
图1
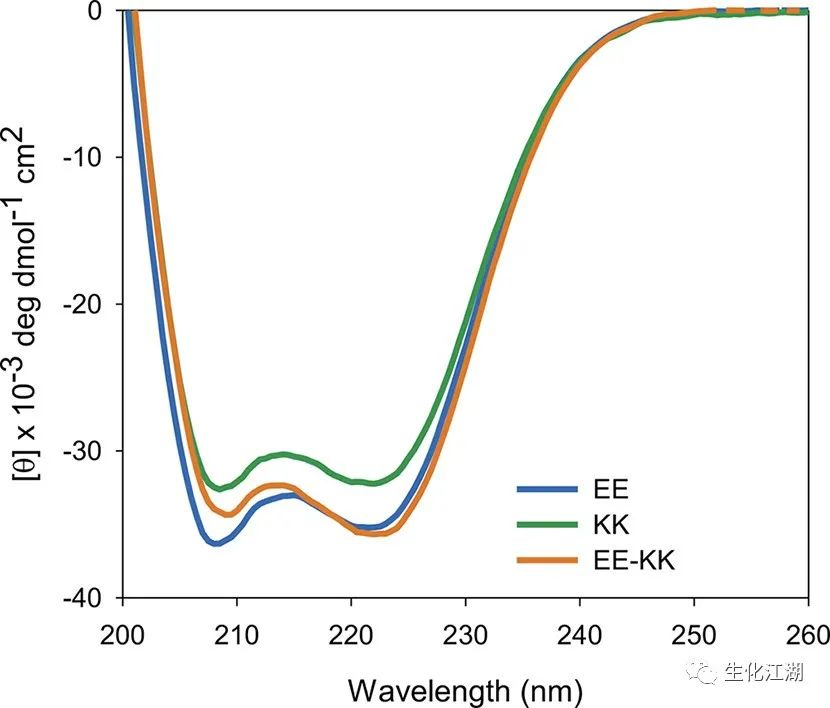
工程蛋白亚基在大肠杆菌中自然表达,并用亲和层析法纯化。为了控制组装过程,EE和KK亚基首先在8 M盐酸胍中变性,然后以等摩尔浓度混合在一起。使亚单位变性也能使荧光变体被包括在随后的实验中,以并入长丝中。通过缓慢降低盐酸胍浓度,蛋白质在24 h内重新折叠并组装成丝状。通过圆二色性对单个EE和KK亚基的二级结构比较表明,这些蛋白质在结构上类似于γ-PFD,并且主要是螺旋状的,最小值在208和222nm附近(图2)。
图2
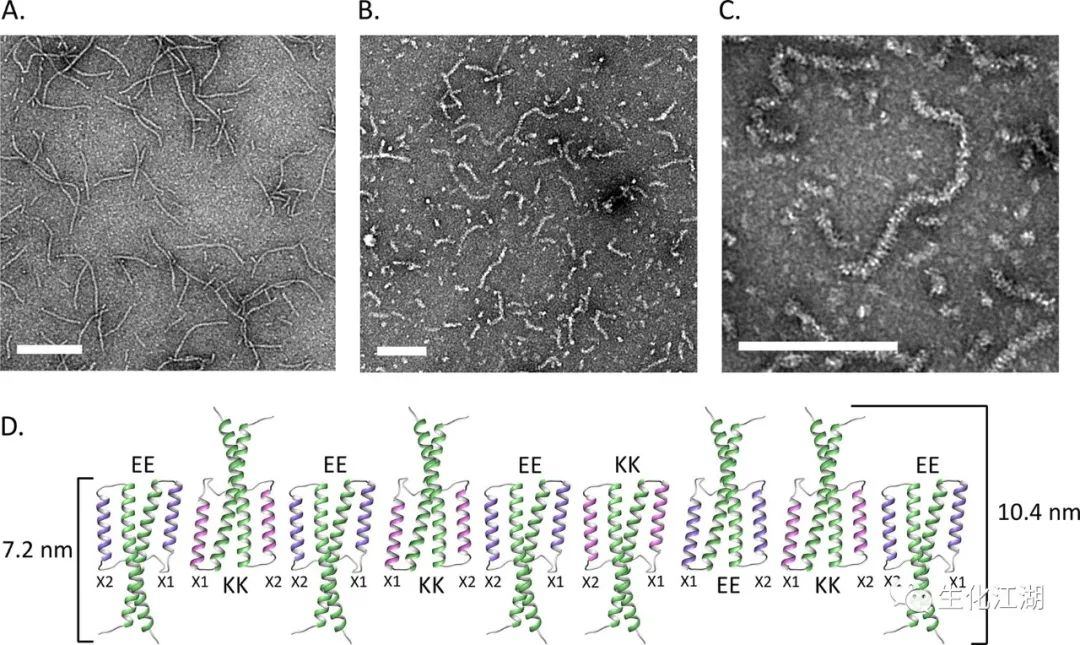
通过TEM在碳载体上对EE和KK亚基分别或作为混合物成像。野生型γ-PFD显示形成了具有特征性的长而相对直的纤丝,平均长度为397nm,宽度为8.6nm(图3A)。EE亚基和KK亚基本身并没有观察到丝的形成。当以等摩尔比组合并重新折叠在一起时,EE-KK混合物形成细丝(图3B)。在三个单独的实验中,对数字化TEM图像中的500条细丝长度进行了测量,结果显示平均长度为288 nm±28 nm。EE-KK丝在外观上具有“管道清洁剂样”的形态(图3C)。这些亚单位被设计成通过反平行的卷曲螺旋组装到X1和X2 β-折叠的螺旋之间。然而,额外的分子模拟表明,亚单位可能通过形成于EE的X1和KK的X1,或EE的X2和KK的X2之间的反平行卷曲螺旋进行组装。这种反向组装将导致子单元对彼此旋转180°(图3D)。
图3
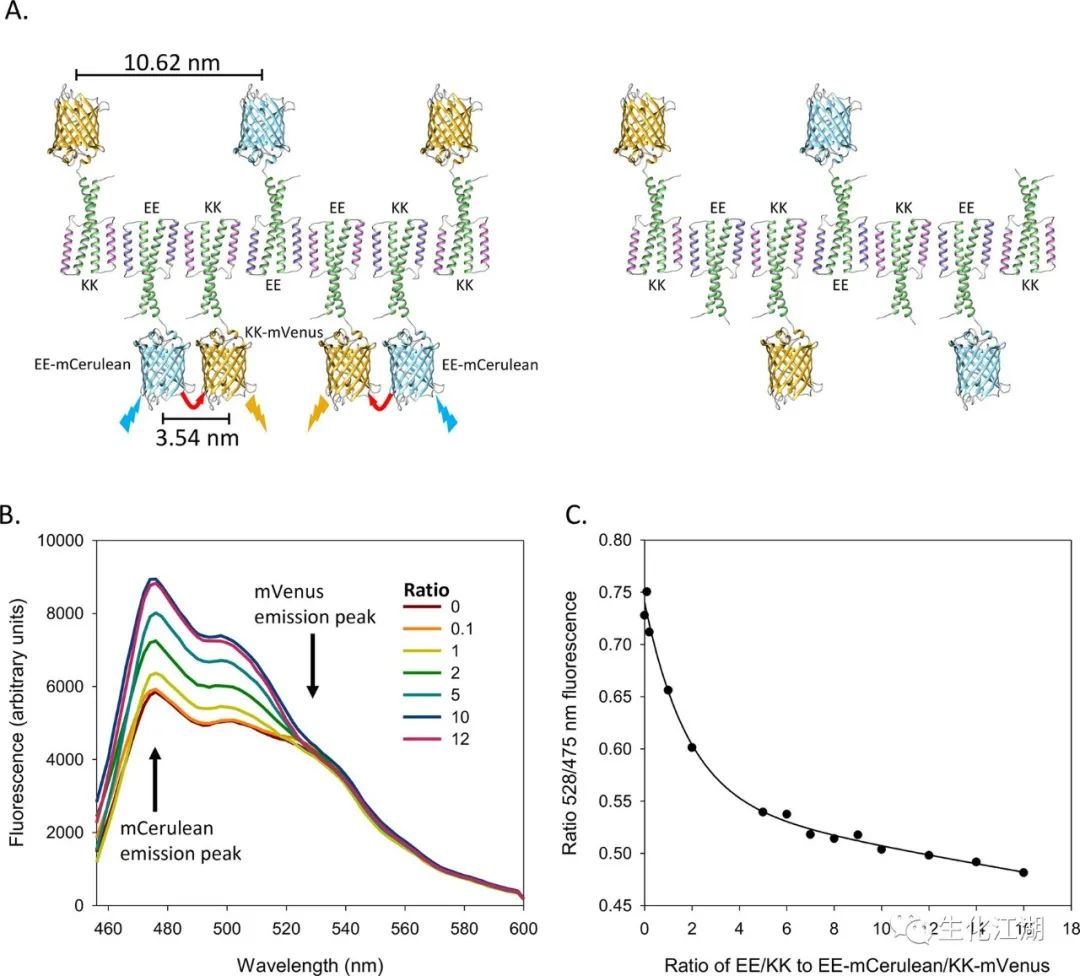
使用两个FRET融合蛋白,用荧光蛋白mCerulean3融合到EE亚基,荧光蛋白mVenus融合到KK亚基。当混合在一起并重新折叠时,EE-mCerulean3和KK-mVenus组装起来,从而使mCerulean3和mVenus结构域足够接近,从而发生FRET。添加EE和KK(不与荧光蛋白融合)导致FRET融合蛋白间隔更远,导致FRET信号减少(图4A)。将0.1到16 µM的EE和KK蛋白与1 µM的EE-mcurulean3和KK-mVenus混合,并重新折叠成丝状。如预期,增加EE和KK亚基相对于FRET对EE-mCerulean3/KK mVenus与FRET信号的显著降低相关(图4B)。通过将475 nm mCerulean3发射峰除以mVenus的528nm发射峰,计算出每个样品的比率FRET活性,并绘制(图4C)。由于组装过程导致亚基沿着聚合物链随机分布,一些EE-mCerulean3将被定位在KK-mVenus附近,从而使FRET发生。当EE/KK增加两倍时,几乎一半的FRET信号丢失,当荧光蛋白间隔太远时,几乎没有出现FRET信号。表明,在非共价合成中,通过调整亚基的比例可以控制功能分子沿模板的空间分布。
图4
基于成功地重新设计了γ-PFD的β-折叠界面,以创造出多组分丝,扩展了制造三组分丝的方法。指定为P1的螺旋序列被引入到γ-PFD的X2位点,其结合伙伴P2被引入到第二个γ-PFD亚基的X1位点(图5A)。为了使γ-PFD的卷曲螺旋主链在每个亚基的方向相同,设计了各个亚基通过反平行卷曲螺旋相互作用。使用与EE和KK亚单位相同的方法,引入X1位置的螺旋序列与最初公布的序列相反。重复在亚单位之间拆分卷曲螺旋序列的过程可以创建三个亚单位,P6:P1,P2:P3,P4:P5应低聚在一起,并作为具有重复亚基的丝状物延伸(图5B)。通过圆二色谱法对单个P6:P1、P2:P3和P4:P5亚基的二级结构比较(图5C)表明,蛋白质在结构上类似于EE和KK亚基,主要是螺旋结构,最小值在208和222 nm附近。用负染TEM对单个亚基和组装的P6:P1-P2:P3-P4:P5丝进行成像。当无论是单个亚基还是三个亚基中只有两个混合并重新折叠在一起,都没有观察到细丝的存在。然而,当所有三个亚基结合并重新折叠在一起时,用TEM观察到丝状体(图5D)。
图5
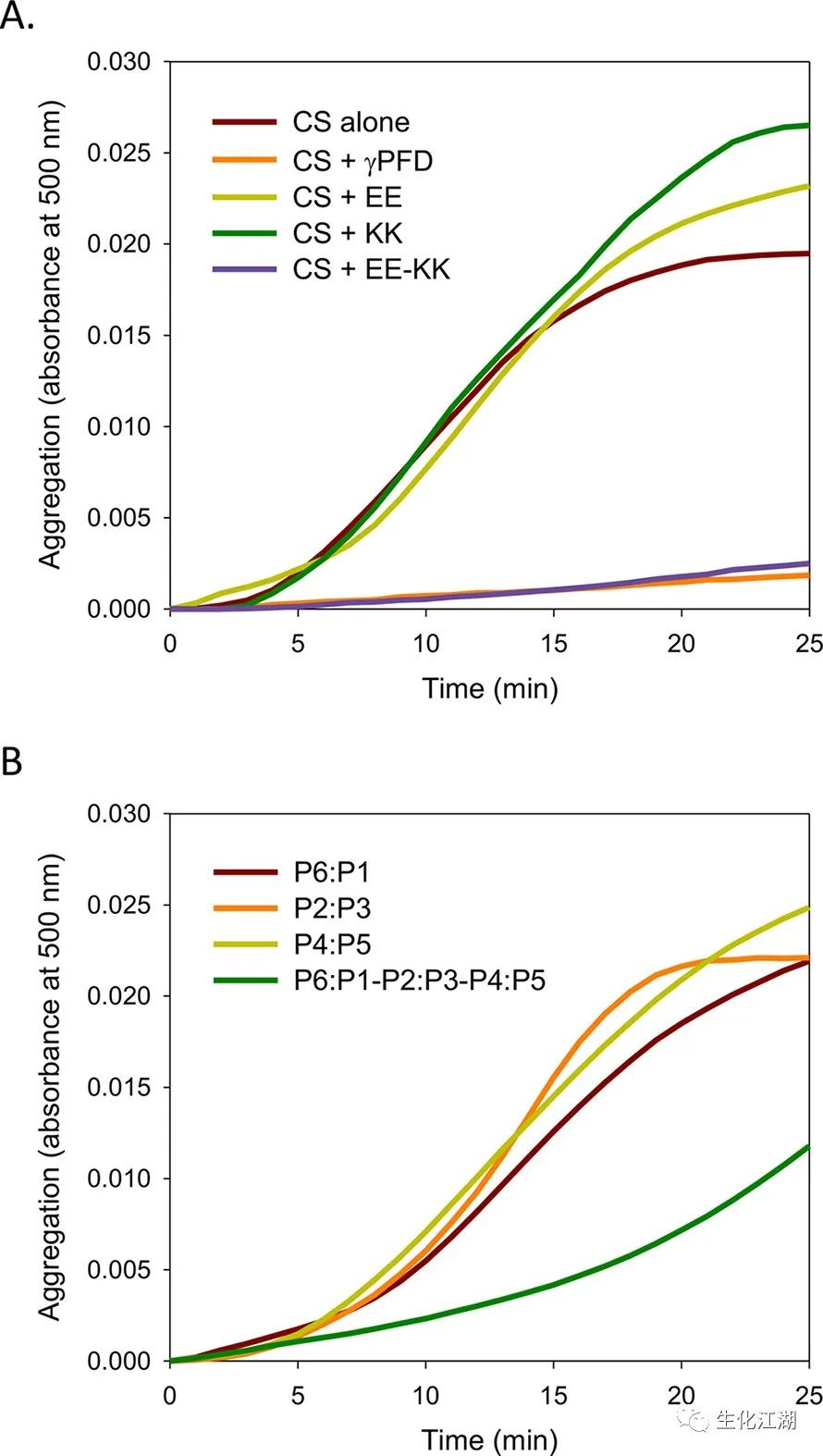
野生型γ-PFD具有分子伴侣活性,可防止多种底物蛋白质的热诱导聚集。研究了异构化丝是否也能稳定和阻止柠檬酸合成酶(CS)的热诱导聚集,包含1:1摩尔比的野生型γ-PFD抑制CS聚集(图6A)。EE或KK亚基单独表现出伴侣活性或不能阻止CS聚集。先前对γ-PFD的伴侣活性的研究表明,该蛋白质必须处于丝状状态才能显示出伴侣活性。事实上,当EE和KK组装成丝状时,观察到与野生型γ-PFD相当的伴侣活性(图6A)。同样,P6:P1、P2:P3和P4:P5亚基除非组装成丝状,否则没有伴侣活性(图6B)。然而,P6:P1-P2:P3-P4:P5丝的伴侣活性不如γ-PFD或EE-KK丝。目前尚不清楚这种低分子伴侣活性的原因,但可能与丝的四级结构和γ-PFD卷曲螺旋的排列有关。
图6
古细菌前折叠素的伴侣功能已被证明与它们的四元结构密切相关。对γ-PFD丝的分子动力学(MD)模拟显示,γ-PFD丝的卷曲螺旋排列形成一个疏水腔阻止变性蛋白质聚集。实验数据表明,稳定不同大小变性蛋白需要特定数量的γ-PFD卷曲螺旋。在CS的情况下,需要6到8个γ-PFD卷曲螺旋与CS相互作用并防止其聚集。尽管P6:P1-P2:P3-P4:P5丝应包含足够数量的γ-PFD卷曲螺旋,但卷曲线圈的排列可能不足以完全稳定变性蛋白质。在γ-PFD的情况下,二聚体亚单位的重复组装导致两条卷曲螺旋沿着形成疏水腔的丝长度排列(图1A)。P6:P1-P2:P3-P4:P5丝状体具有单排列的卷曲螺旋和缺乏疏水腔(图5B)可能无法完全阻止变性蛋白质和阻止聚集。EE-KK丝(图3D)的反足组装可能导致卷曲螺旋以不同的角度向外突出,能够更好地捕获变性蛋白质,从而产生比P6:P1-P2:P3-P4:P5细丝更大的伴侣活性。
小编有话说:
该研究提出了一种工程化蛋白质亚基界面的方法,以创建能够控制功能分子空间分布的多组分长丝。利用多个正交卷曲螺旋的模块性,首先创建了一个双组分组件(A-B-A-B-等),该组件可以形成几百纳米长的细丝。用比例法Förster共振能量转移(FRET)方法研究了分子沿丝的组装和间距。随后,设计了一种具有分子伴侣活性的三组分丝(A-B-C-A-B-C-等),它可以减少不耐热蛋白的聚集。这些能够在空间上控制功能分子定位的多组分模块化组合的建立为生物和纳米材料设计、酶和代谢工程以及分子传递开辟了新的方向。
撰稿:张芝琳
校稿:刘伟

关注我们了解
更多
微信号:
BioChemWorld
今天的文章什么是蛋白质结构域?什么是蛋白质模体?两者有何差别_蛋白质亚基之间通过什么连接分享到此就结束了,感谢您的阅读。
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌侵权/违法违规的内容, 请发送邮件至 举报,一经查实,本站将立刻删除。
如需转载请保留出处:https://bianchenghao.cn/87929.html