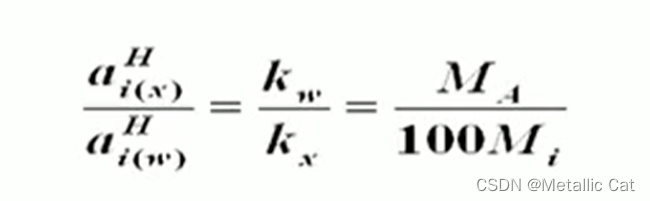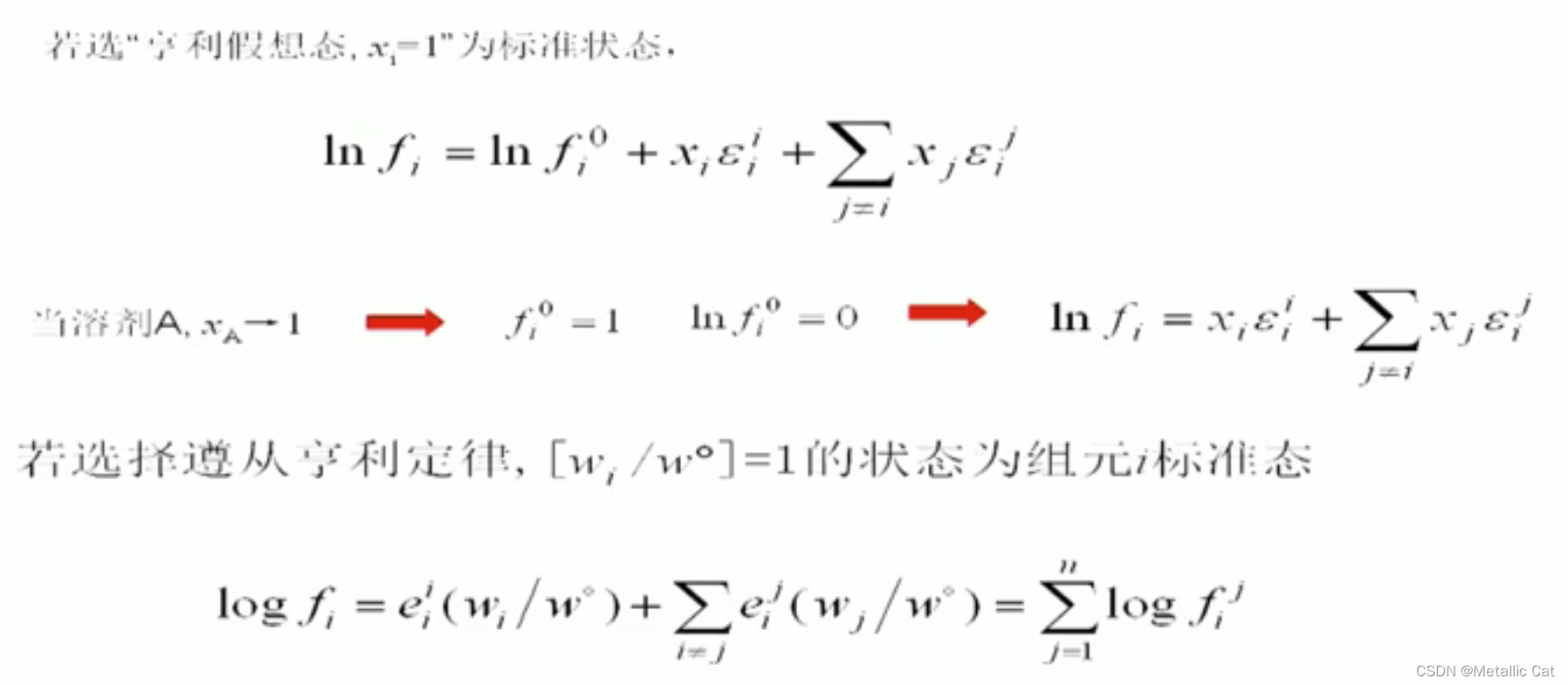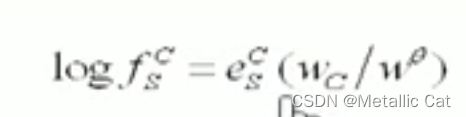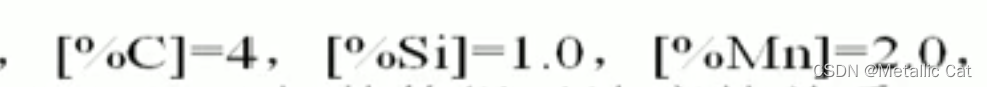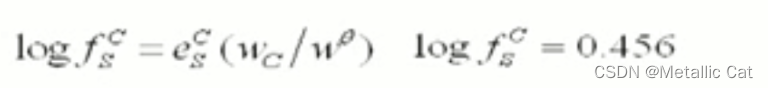第一部分 — 活度标准态转换
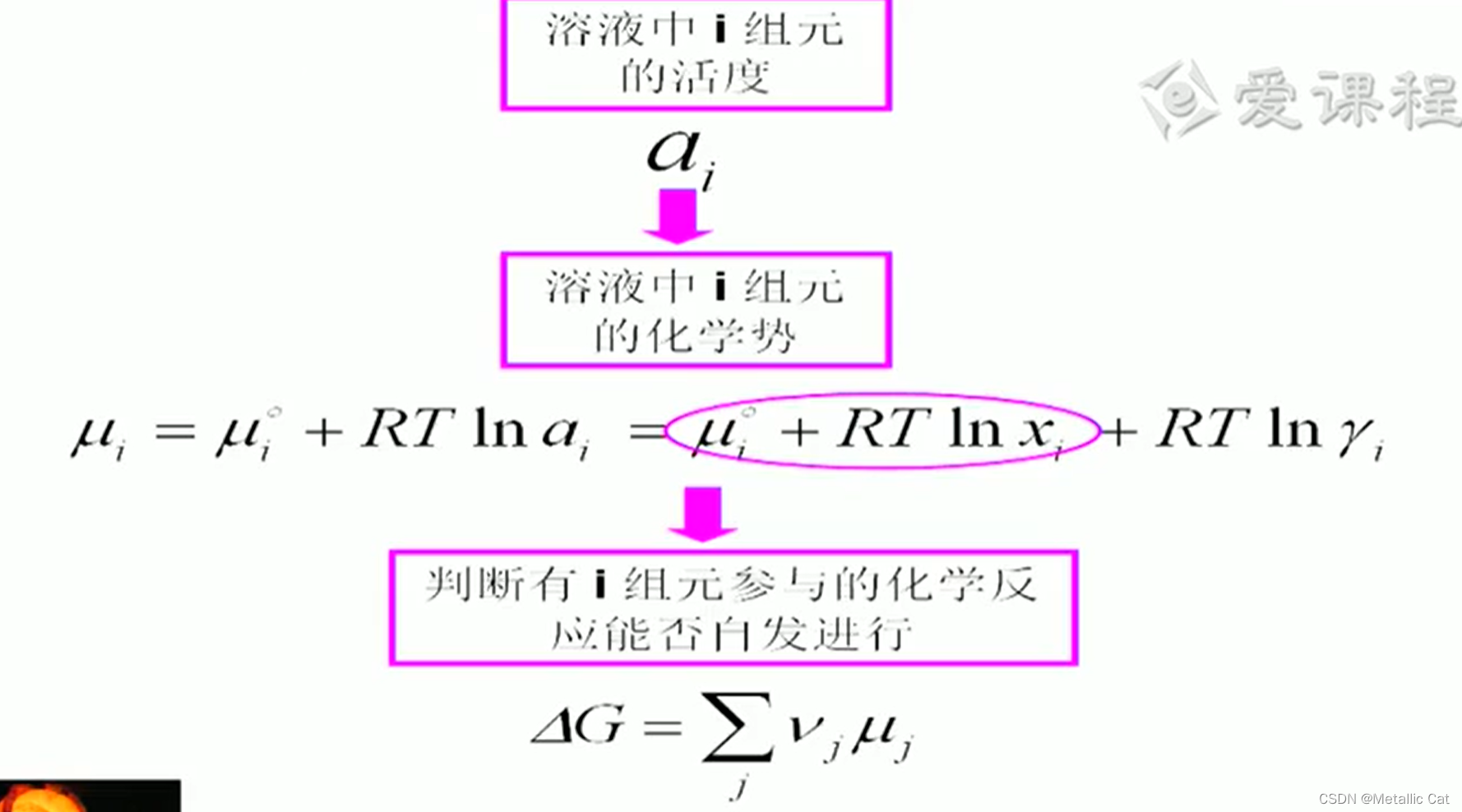
这里面被圈中的部分是溶液为理想溶液时计算得到的化学势,后面那一部分则是对理想溶液下计算得到的化学势进行的修正
吉布斯自由能变等于 = 反应物和生成物的自由能之和,其中在求和之前必须给每一个生成物/反应物乘上其对应的化学计量数,并且反应物的化学计量数都得在加上负号之后再用来乘和求和。
对了这个化学计量数的符号表示就是上面那个 Vj
接下来开始讲不同标准态下的活度之间的换算
aR是符合拉乌尔定律下的活度,aH是符合亨利定律下的活度
当溶液无限稀的时候,溶液符合亨利定律,所以此时亨利定律的修正系数就变为了1(已经符合定律 ,处于不用修正的状态)
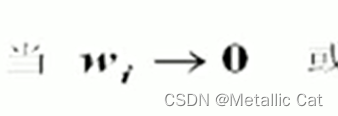
xi趋于0的时候,溶质无限稀,符合亨利定律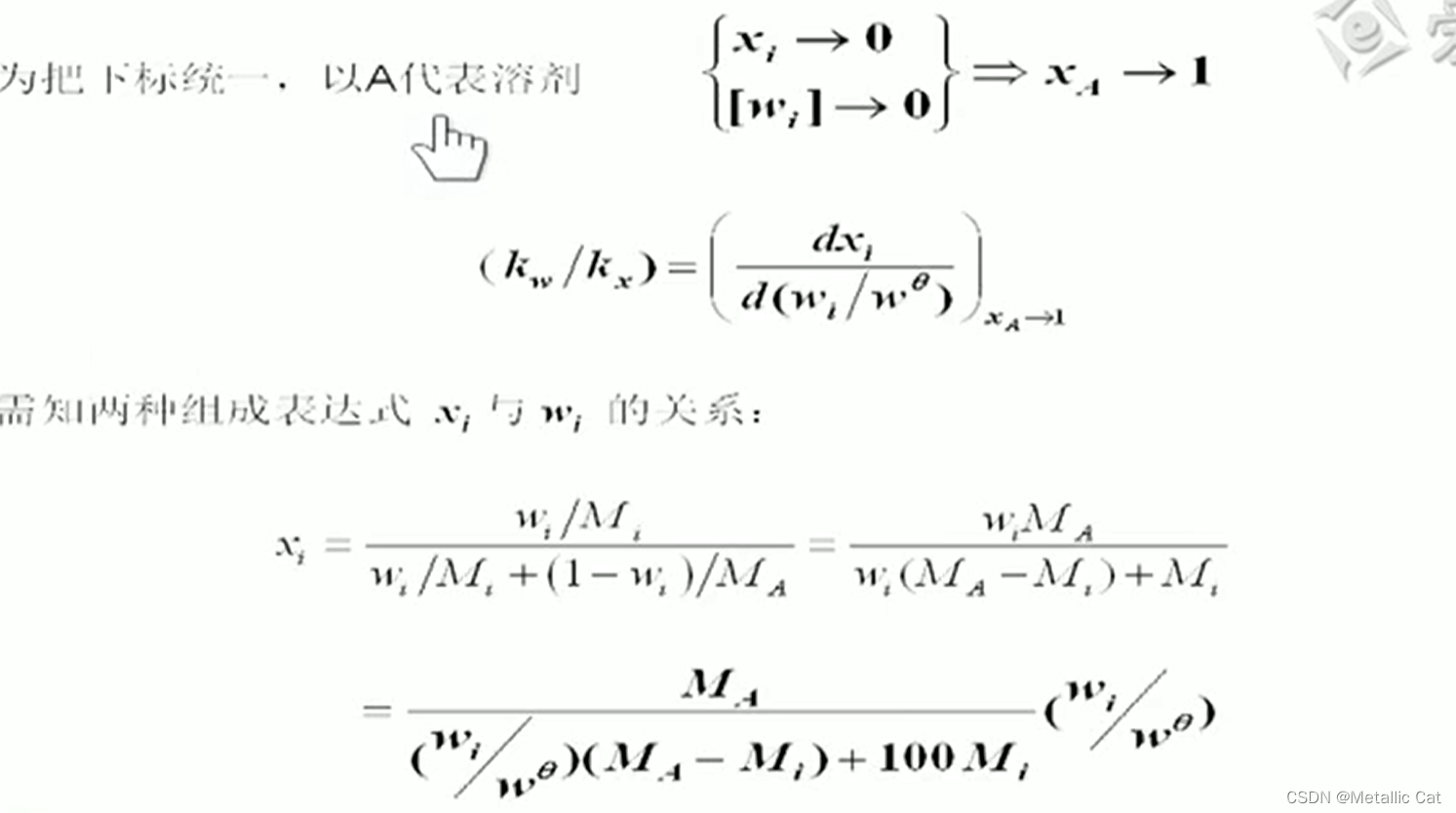
经过一系列变换之后就得到了xi与wi之间的关系
wΘ 等于 1/100
kw和kx都是常数,无论是在哪个浓度组成下求得它们的比值,其它所有浓度组成下的这两个的比值就都知道了,所以我们通过求溶质浓度趋于0时的这两的比值,进而求得所有情况下的比值
A是溶剂
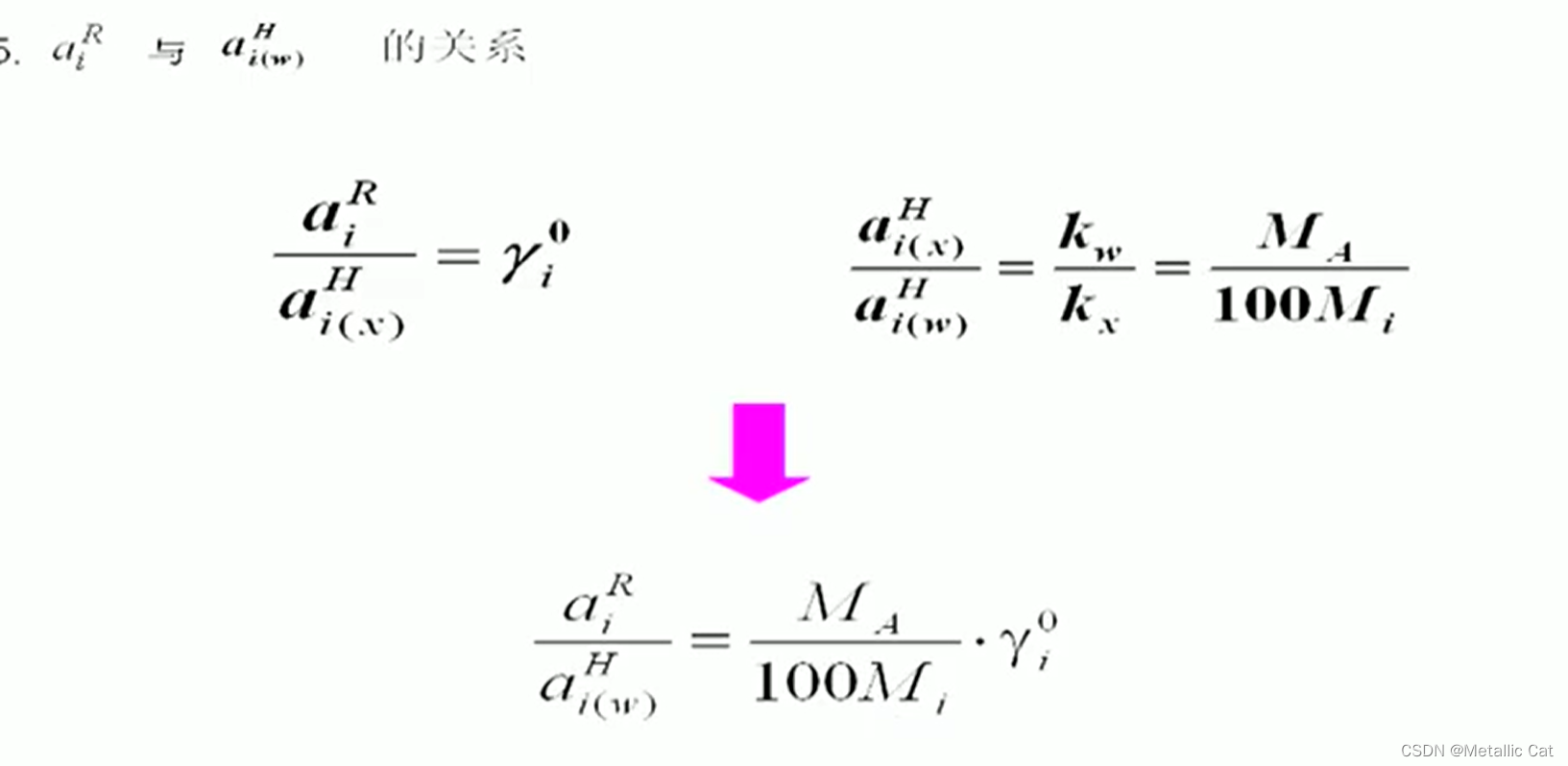
已知活度之间的关系的话,我们就可以开始求活度系数之间的关系(满足亨利定律的前提下)
当wi趋于0的时候,溶液同时符合质量浓度下的亨利定律与摩尔浓度下的亨利定律,所以不需要修正,所以此时两种标准态下的修正系数都等于 1
γi0是活度之比的结果,它等于 γi / fi
综上我们就有了aiR ,aiH和aiW之间的关系
第一个是“故仅涉及活度系数”
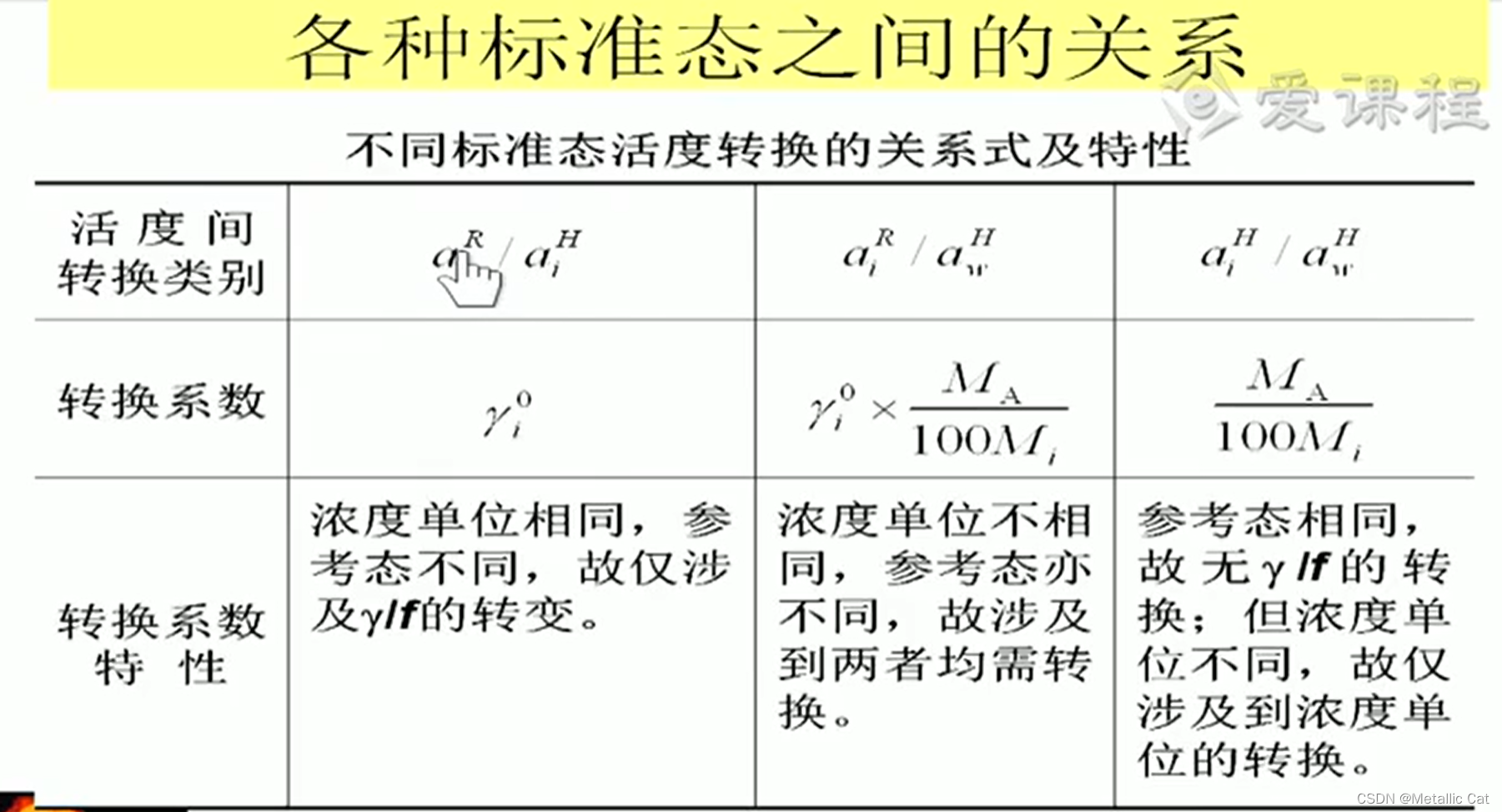
标准态之间的转换涉及到两种状况:
1.浓度单位不一致(摩尔浓度,质量浓度)
2.对应的定律不一致 — 标准态不一致 (亨利和拉乌尔)
将不同的转换为相同的就完成了转换了
活度与温度和压力之间的关系
组成xi与温度无关,所以组成xi与温度的偏导等于0,而活度系数则是一个与温度相关的量
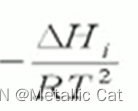
上面这个为正值的时候,活度与温度成正比,反之成反比
如果吊塔Hi等于0的话,温度对活度没有影响
可以认为活度/ 活度系数与压力无关
第二部分 — 活度相互作用系数
以拉乌尔定律为依据的时候的活度相互作用系数
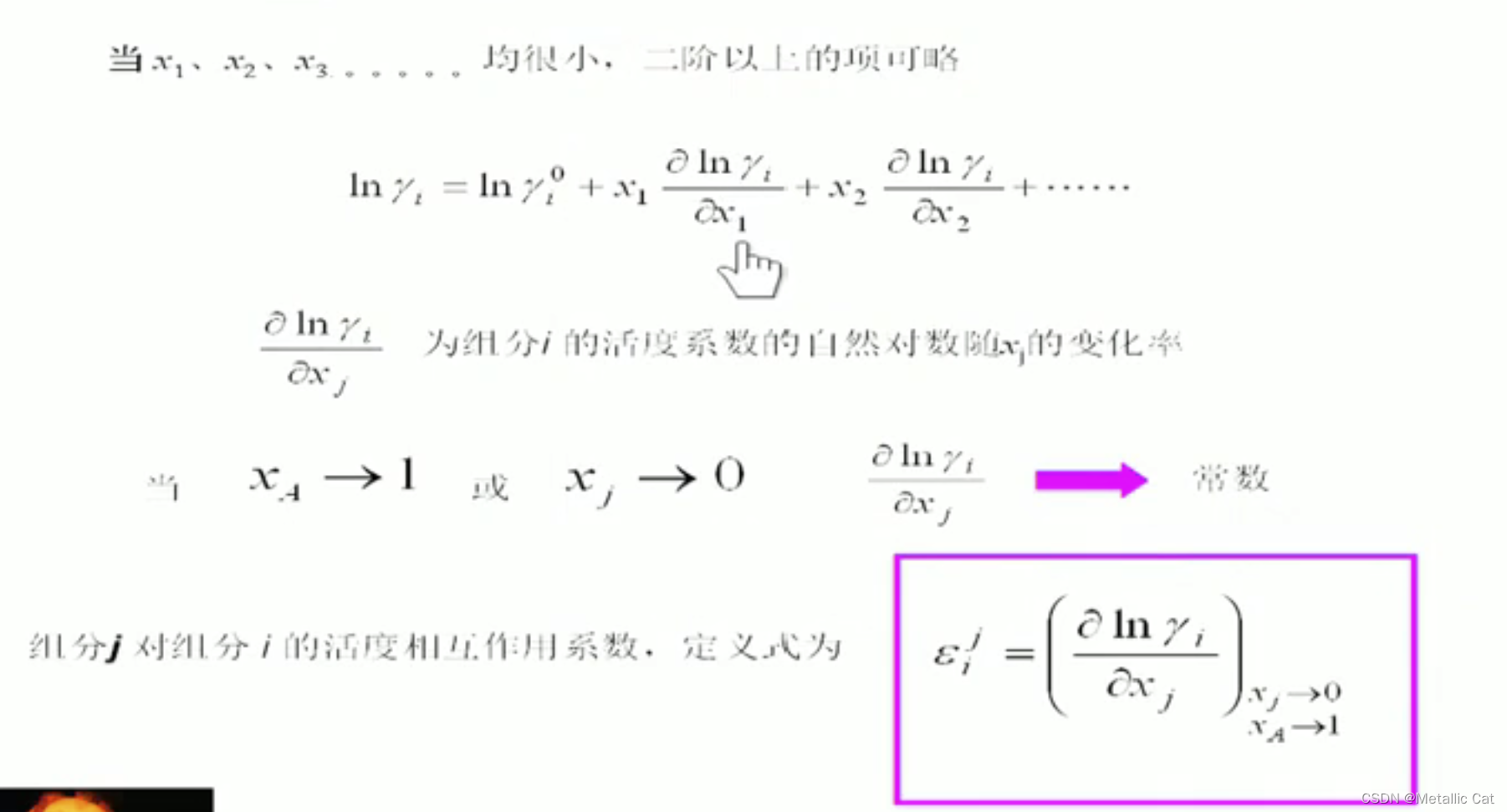
在多组分系统当中,i 组元的活度系数是和溶液的组成相关,所以在恒温恒压的条件下,我们有上图中那样的关于活度系数 ln值 的公式
γi0表示的是除xi组元以外的组元都消失的时候,组元 i 的活度系数
由于xi趋于0,所以说二阶以上的展开项可以直接忽略掉,只留一阶展开项
对A – i 二元系的意思是溶是A,溶质是 i 的一个二元系
从只能描述无限稀溶液拓宽到能够描述极稀溶液,这个极稀溶液仍然要保证(摩尔浓度与分压保持线性关系)
以亨利定律为依据来求活度相互作用系数
上面这个最后一个公式的意思是,i组元的活度系数的Log值等于所有i组元在每一个组元影响下的活度系数的log值之和
如下面这个图求的就是碳的浓度对s的活度系数的贡献
上面两个分别是拉乌尔定律下的活度相互作用系数(选用摩尔浓度)和亨利定律下的活度(选用质量浓度)相互作用系数(包括自身相互作用系数)
这里面符号的意思是【%X】= a x元素在溶液中所占的质量分数为百分之a
例题如上:
上面这题中由于c的质量分数较大,已经不再极稀溶液的队列当中了,所以说不能用极稀溶液状态下的线性计算来求其对s的活度系数的贡献了,即:
这个是被否决的,我们应该直接选择查表或者题目给的c对s的活度系数的贡献,即左边这个:
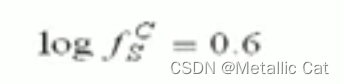
ps : 10的log(fs)次方就等于 fs
一定要在极稀溶液的条件下,使用活度相互作用系数来计算活度
今天的文章物理化学复习【2】– 活度标准态转换与活度相互作用系数分享到此就结束了,感谢您的阅读。
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌侵权/违法违规的内容, 请发送邮件至 举报,一经查实,本站将立刻删除。
如需转载请保留出处:https://bianchenghao.cn/85728.html